发布时间:2025-06-03 14:10:50 点击量:
HASH GAME - Online Skill Game GET 300临时专利申请需在提交后一年的时间内转为正式申请,之后再过6个月,该专利申请将被公开发表。也就是说,从申请之日起,专利可拥有长达18个月的“潜水期”。在此期间,除非申请人主动披露,外界无法获知该专利申请的存在。这一潜水期给竞争对手带来诸多不便。当一家公司试图开发某项新技术或新产品时,通常需要先对相关领域的专利格局进行尽职调查,以避免在知识产权已被占领的赛道上浪费时间和资源。然而,潜水期内的专利申请并无法被查询到,从而增加了创新开发的风险。
自2000年起,Pharmasset开始尽可能广泛地测试各种类型的核苷。除了筛选渡边的化合物库中的分子,团队还收集了文献中已有的以及市面上可以买到的核苷,一起进行测试。公司最早购买的化合物之一,是从Sigma-Aldrich购入的一个2-甲基化合物。 初步测试显示该化合物具有一定活性,但也表现出较明显的毒性。Pharmasset团队决定尝试合成一系列结构相关的类似物,尤其是在2位置上同时具有甲基或其他取代基的化合物。
当时,公司内部绝大多数人并不知情054专利申请的存在。2001年10月15日,斯图伊弗带着一大堆资料,兴冲冲地去找公司的专利律师雪莉·诺尔斯(Sherry Knowles),说道:“你看,这是我们刚刚在筛选中发现的一些新化合物,我觉得我们应该开始申请专利了!” 诺尔斯也是Idenix的专利律师。她扫了一眼化合物清单后,当场给斯图伊弗泼了一盆冷水:“你们可以继续研究它(2-甲基上向、羟基下向的胞苷),但它不属于你们。所有带2-甲基的核苷都不属于你们。” 她向斯图伊弗大致透露了054专利申请的核心内容,并指出这份申请将在两个月内公开。
除了2-甲基核苷, Pharmasset团队还发现了另一个有活性的化合物——2-氟下向(2-fluoro-down)胞苷。 这是渡边的化合物库里的一款化合物,被编号为PSI-0262。早在1999年,施纳齐、利奥塔与C.-K. David Chu等人就已发现2-氟胞苷对多种病毒具有活性,并由埃默里大学申请了专利。虽然PSI-0262对HCV展现出强效的抑制作用,但其选择性较差,与人的DNA聚合酶也有较强的结合,限制了其作为抗病毒药物的治疗潜力。
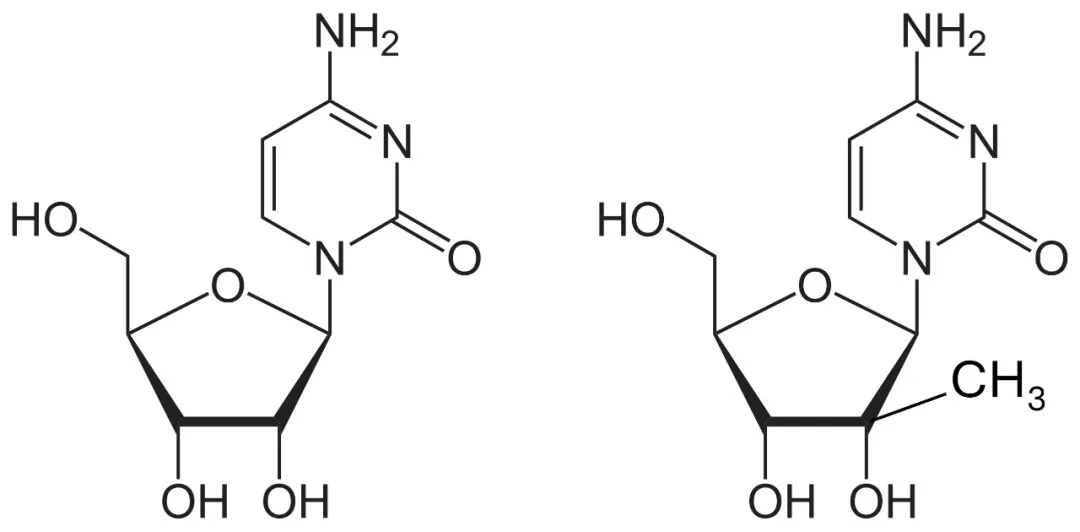
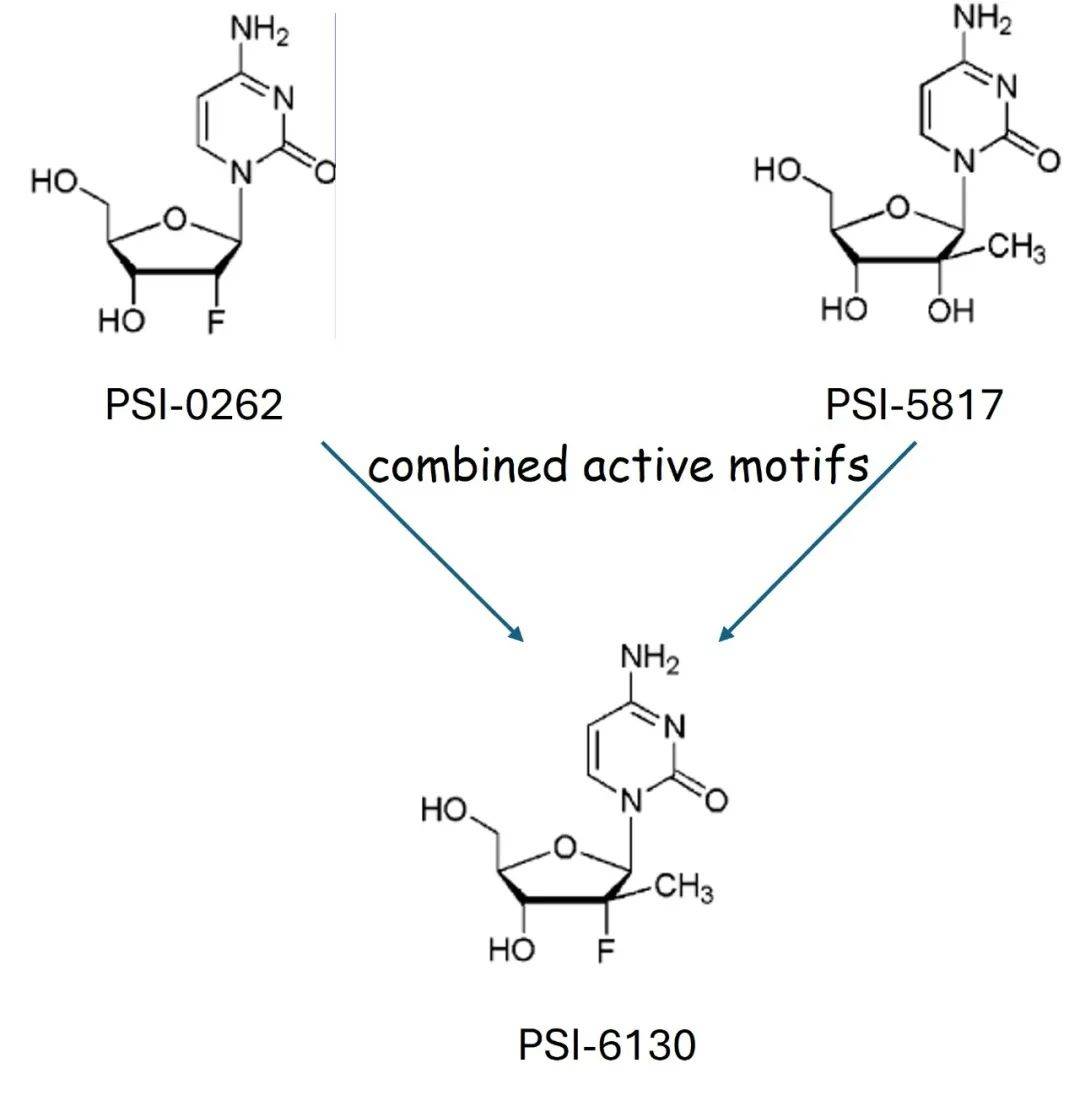
在2002年的实验记录本上,斯图伊弗画下了一幅草图:左边是2-氟脱氧胞苷的化学结构式,标注为 PSI-0262;右边是 2-甲基(上向)胞苷的结构式,标注为 PSI-5817。图中两条带箭头的线分别从这两个分子出发,汇聚至中间的一个分子——PSI-6130。两条箭头之间写着“组合的活性基团”(“Combined Active Motifs”)。斯图伊弗回忆道,“一个分子中的氟(下向)基团是具有活性的化合物,另一个分子中的甲基(上向)也是活性的化合物。如果将这两个基团组合在一起,就得出了PSI-6130。这种想法基于结构-活性关系(structure-activity relationship,SAR)。它有可能是有活性的,也可能是无活性的,或者可能表现为毒性很大的一种抗代谢物(antimetabolite)。当时这只是我提出的一个想法。在2002、2003年,我们并不知道这个想法是否可行。”
2002年11月的一天,克拉克走进CSO奥托的办公室,提出要合成一批新化合物,其中之一就是PSI-6130。 他并未详细说明这些化合物为何值得一试,但随身带来了一些打印资料,包括默沙东和Idenix的专利申请。 他应该是仔细研究了竞争对手的专利申请之后才提出这个计划的。多年后,奥托回忆道,“ 他喜欢挑战。我认为他最大的动力来自于这是一个全新的化合物,是别人从未合成过的,这对他来说是一个能够做出独特成果的机会……他希望这个化合物具有活性。但在那个时间点,他不知道结果会如何,我也不知道。”
2003年5月19日,PSI-6130 首次在复制子实验接受测试,结果显示其具有非常强的抗病毒活性, EC90(达到90%效应所需浓度)约为 2.5 微摩尔。而它在BVDV模型中却没有表现出活性。如果当时公司没有付费引进复制子系统作为主要的筛选平台,也许PSI-6130永无出头之日,也就没有后来的丙肝神药索磷布韦。另一方面,这一结果表明,PSI-6130 对HCV具有高度特异性,而非对整个黄病毒家族广泛有效。高选择性往往预示着良好的安全性。
PSI-6130的神奇之处在于:若仅在 2 位引入甲基或氟基团,所得的核苷往往表现出较高毒性;但当这两个取代基同时存在时,PSI-6130却几乎不显示毒性。在体外实验中,PSI-6130的效力是Idenix化合物(NM-107)的5倍,和默沙东化合物(MK0608)效力相当。另外,PSI-6130能抑制多种HCV基因型的NS5B聚合酶,而且不易引起HCV的耐药性。具有这些良好特性的PSI-6130为Pharmasset后续丙肝药物的开发奠定了良好的基础。
2005年初,克拉克从Pharmasset辞职。三年后,克拉克一纸诉状把施纳齐告上了法庭,试图推翻他们在2005年签的Pharmasset雇佣协议中的专利权转让条款,并要求把PSI-6130的专利权利从Pharmasset手里转归自己名下。打了两年官司后,克拉克的申诉均被法院驳回。2012年3月,在吉利德完成对Pharmasset的收购之后,克拉克再次发起仲裁程序。最终,仲裁小组于 2013 年 6 月作出对吉利德和施纳齐有利的裁决,驳回了克拉克的诉求。
截至2004年初,Pharmasset公司共有员工30人,已从两家机构投资者——德国慕尼黑的TVM Capital和美国波士顿的MPM Capital——累计筹集了1600万美元的风险投资。此外,公司还成功申请获得了美国国立卫生研究院(NIH)旗下机构颁发的九项小企业创新研究(SBIR)资助,总金额超过100万美元。此外,杜邦制药公司(Dupont Pharmaceuticals Co.)也持有该公司2.2%的股份。
8月底,Pharmasset和Apath重新谈判,废除了此前关于HCV复制子技术的许可协议,并签署了一份新的协议。根据新协议,Pharmasset向Apath支付了一笔一次性再许可费用55万美元,并同意自2000年10月起追溯每年7.5万美元的维护费用。与原协议不同的是,Pharmasset今后无需再就PSI-6130未来的销售或转让收入向Apath支付任何提成。至此,PSI-6130成为一项“干净”的资产。这为Pharmasset以该项目为基础寻求外部合作铺平了道路。
2004年10月,Pharmasset与罗氏达成合作协议,联合推进PSI-6130 及其前药(包括后来研发的 RG7128,即mericitabine)的开发与商业化。根据协议,Pharmasset负责部分临床前开发工作、IND申请及早期临床试验, 而罗氏将承担其余所有其他临床前研究、后续的临床开发以及产品商业化的全部费用与责任。罗氏支付800万美元预付款,并承诺为Pharmasset报销最高达450万美元的相关费用。此外,若项目顺利推进,Pharmasset有望获得总计高达约1.05亿美元的阶段性里程碑付款,并在产品上市后会获得基于销售额的提成收益。
自1998年起,Pharmasset一直在亚特兰大地区租用一处隶属于施纳齐关联基金会的办公室与实验室,每年租金超过20万美元,原租约至2008年10月31日。2005年5月,Pharmasset在新泽西州普林斯顿签署了一份新的办公室和实验室场地运营租赁协议,并于当年年底完成了从乔治亚州到新泽西州的整体搬迁。2006年2月,公司正式终止了与基金会的旧租约,并支付了140万美元的一次性终止费用(包括保证金余额及场地维修费用)。Pharmasset与施纳齐进一步实现了业务上的切割与独立。
为了提高PSI-6130的成药性,Pharmasset采用了前药(prodrug)策略。RG7128就是PSI-6130的一款前药: 以PSI-6130为母体核苷,在3- 和 5- 羟基(hydroxyl)位点分别引入异丁酰基前药基团。这样的结构修饰使RG7128在胃肠道中更稳定,能够被高效吸收,并在进入全身循环后逐步释放出活性成分PSI-6130。它提高了PSI-6130的体内暴露水平,同时减少了其向无活性的尿苷衍生物的代谢转化。在罗氏的主导下,RG7128(mericitabine)顺利推进至二期临床试验阶段。

索菲亚从PSI-6130身上看到了巨大的潜力。在随后的几年里,他带领团队围绕该分子开发出一系列前药,其中以RG7128的药代动力学(PK)数据最为出色: 在大鼠体内,其血浆浓度–时间曲线下面积(AUC)超过同剂量PSI-6130的五倍。RG7128在一、二期临床试验中也展现出良好疗效:对于基因型1型HCV感染患者,单药每日两次、每次1克治疗14天,可使病毒RNA水平下降约500倍;联合标准疗法(聚乙二醇干扰素加利巴韦林)治疗4周,则达到了 88%的快速病毒应答率(RVR)。此外,RG7128 也在以往对治疗无反应的基因2型和3型患者中表现出一定的疗效。
前文提到,部分PSI-6130会在体内代谢为无活性的尿苷衍生物(图14)。这个尿苷衍生物——PSI-6026——之所以无活性,是因为它无法在细胞中被磷酸化为单磷酸形式PSI-6026-MP。然而,PSI-6130 本身却可以在肝细胞内被激酶依次磷酸化为 PSI-6130-MP、再转化为 PSI-6026-MP,并最终代谢为具有抗病毒活性的 PSI-6026-TP(三磷酸形式)。PSI-6026 在罗氏内部的代号为 RO2433。罗氏的研究人员发现,PSI-6130-TP 和 RO2433-TP
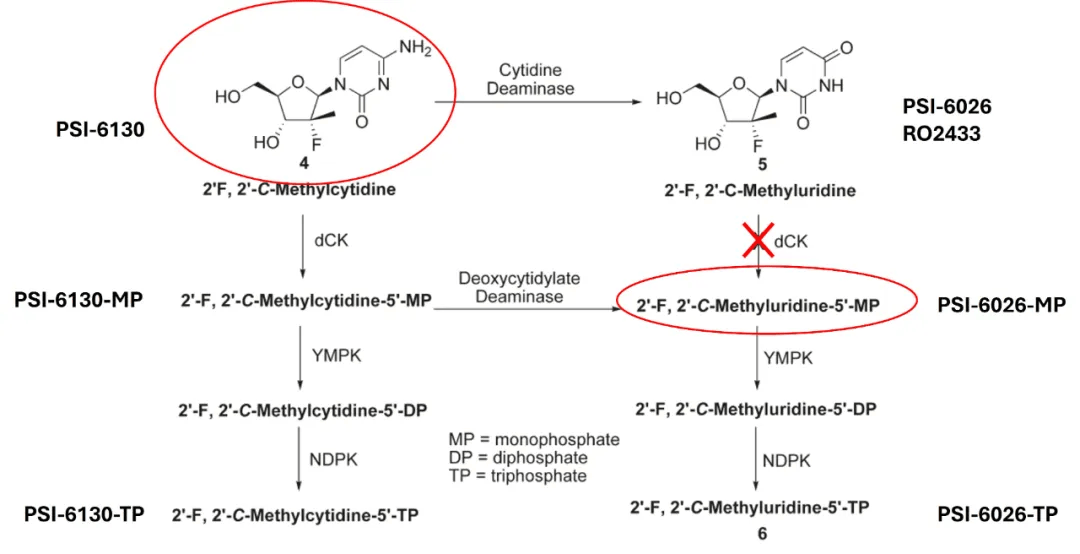
有一天,索菲亚和几个同事正在办公室中深入探讨PSI-6130衍生药物的开发策略。他们在纸上列出了PSI-6130的完整代谢路径,标注出每一个关键代谢中间体的化学结构式和相互转换的关系。索菲亚盯着图纸,忽然他指着其中一个结构——PSI-6026-MP(即 PSI-6026 的单磷酸形式)说道:“这就是答案!”他提出,与其继续围绕 PSI-6130 开发前药,不如直接开发 PSI-6026-MP 的前药。这一新思路可以规避 PSI-6026 无法被激酶磷酸化的关键障碍,同时还能利用 PSI-6026-TP 在肝细胞中长达 38 小时的半衰期,实现更强效、更持久的抗病毒作用。
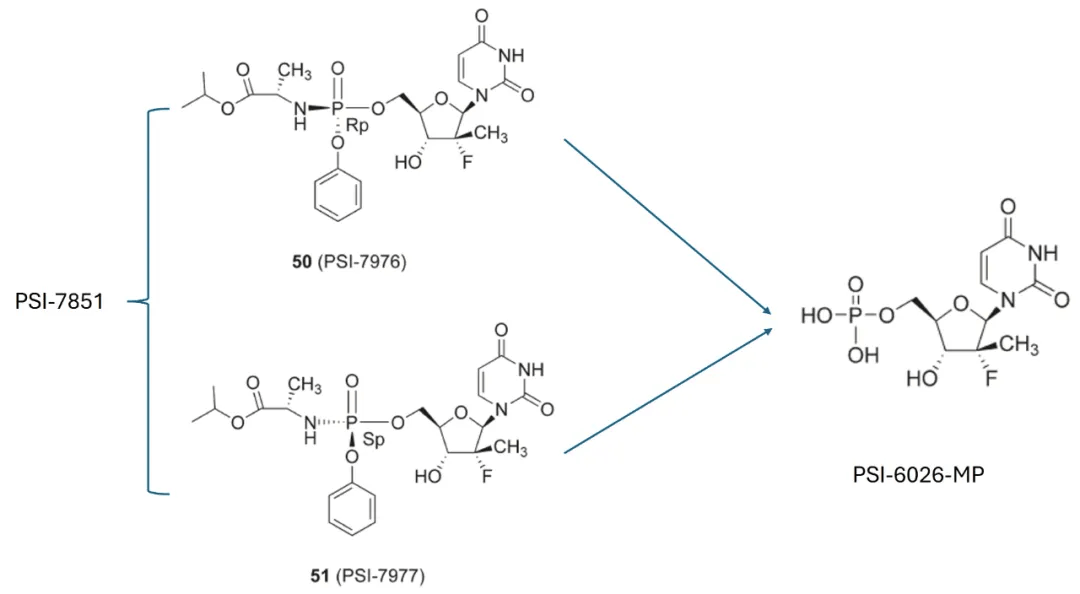
PSI-6026-MP本身进膜性差,需要通过前药被掩蔽成一种磷酸酯形式。Pharmasset的策略是设计一系列以PSI-6026-MP为“药核”的、具有更好脂溶性的磷酰胺酸酯前药(phosphoramidate prodrug)。他们的第二个关键创新在于巧妙地利用了肝脏的首过代谢作用(First pass metabolism)。所设计的前药在胃肠道中保持稳定,在被吸收后到达肝脏时才被酶激活,精准释放出有活性的 PSI-6026-MP。
经过反复合成、测试和优化,这一系列努力最终促成了PSI-7851 的诞生。在体外研究中,PSI-7851 显示出卓越的抗HCV活性,其 EC₉₀值为 0.44 μM,比PSI-6130的活性代谢物效力高出14至17倍。此外,PSI-7851 在体外实验中对 HCV 1、2、3 和 4型基因型均表现出广谱活性,同时具备极低的细胞毒性。更重要的是,PSI-7851 不仅能够有效清除转染细胞中的HCV复制子,而且在停药后未观察到病毒反弹。
尽管施纳齐后来在公开场合多次强调自己在索磷布韦研发过程中的关键作用,其实际贡献却存在颇多争议。他确实是2005年那篇关于 PSI-6130 设计与合成的论文合著者之一,但没有参与后续的研发工作。他曾经的好友、商业和学术合伙人、现任Atea制药公司CEO的索马多西表示:除了创办Pharmasset这家公司,施纳齐在索磷布韦的实际研发中 “并未参与任何工作”。索菲亚表示:“他有远见,创办了这家公司。” 但在谈及索磷布韦的发明本身时,索菲亚直言指出:“你(可以)去查查那些专利和论文——在这个药物的开发中有40多项成果,他的名字在发明人或作者中都没有出现。”
罗氏曾拥有一项选择权,可在合作期间内(截至2006年12月31日)对除 PSI-6130 及其前药之外、在此期间显示出HCV聚合酶活性的某些化合物执行授权许可。行使该选择权的有效期截至 2007年3月31日。然而,罗氏最终并未行使该权利。PSI-7977姗姗来迟,2007年才正式问世,2008年才开始积累临床前数据。由此,罗氏与PSI-7977擦肩而过,Pharmasset 也因而得以保留对该化合物完整的开发与商业化权利。(2013 年 3 月,罗氏还是试图通过仲裁程序挑战 Pharmasset 和吉利德对 PSI-7977 的权利归属。但一年半后,仲裁小组裁定罗氏无权获得任何赔偿。)这为其他制药公司留下了机会。而最终成功抓住这颗钻石的,是一家中等规模的生物技术公司。

企业战略的本质是取舍。资源的有限性使得战略的制定与执行成为必然。如果一个企业拥有无限资源,它无需战略——凡是投资回报率(ROI)超过某一门槛的项目都可同时推进,无需权衡选择。正因为现实中资源的稀缺,企业必须做出聚焦:从众多可能中选定一个方向,放弃其他选项。正确的战略,就是“好钢用在刀刃上”。“好钢”代表有限的资本与人才,而“刀刃”则是企业的核心竞争力。要打造一把锋利无比的“宝刀”,取舍是不可或缺的前提。
吉利德并未止步于此。它随后联手BMS,以 Emtriva 为基础,于2006年7月推出了Atripla——这是一种将 Truvada 与 BMS 的 Sustiva(依非韦伦,efavirenz) 结合的三合一复方药片。Atripla 用一片药取代了部分患者原先每天需服用的多达 32 种不同的药物,不仅大大简化了治疗流程,还显著提高了患者的生活质量和用药依从性。这种简化方案降低了因漏服或不规律用药而产生耐药病毒株的风险。吉利德推出首个单片疗法后,患者体内的耐药性下降了十倍,美国的治疗覆盖率也提高了两倍以上。如今,得益于这类单片疗法,HIV 患者已能拥有接近正常的预期寿命。
单片疗法的开发过程非常艰难,吉利德为此投入了整整两年时间。最大的挑战在于:如何将三种不同的药物整合进一颗小小的药片中,并确保它们在体内的吸收效果不逊于单独服用。这远远不是将三种药简单“混合压片”那么容易。吉利德的科学家们必须确保这三种药物在患者体内都能被适当吸收。因此,他们最终采用了“双层结构”的创新设计——将自家开发的两种药物压制在药片的一侧,而将依非韦伦独立压制在另一侧。在找到最终理想配方之前,吉利德共在人体中测试了五种不同的原型药片,才最终成功研制出 Atripla。
吉利德“一天一片药”的战略决策,最终为公司带来了丰厚的回报。在上世纪90年代中期,几乎所有大型制药公司——包括GSK、BMS、辉瑞(Pfizer)、雅培(Abbott)、罗氏和默沙东等行业巨头——都在激烈争夺HIV治疗市场。而在接下来的十年里,吉利德从一家仅有35名员工、举步维艰的小型生物科技公司,逐步崛起为全球领先的HIV药物制造商。到2011年,吉利德员工人数已达4,500人,市值突破300亿美元。据估计,2009年,在美国和欧洲,约60%的HIV感染者在治疗过程中使用过吉利德的四款HIV药物中的至少一种;在新确诊患者中,这一比例甚至高达80%。吉利德由此走上主导全球HIV治疗市场的道路。
吉利德计划在2020年前开发出广谱基因型口服抗HCV药物。但这一领域竞争激烈、研发节奏迅猛,原定的时间表正被迅速压缩。2011年,丙肝治疗领域迎来一场革命。美国FDA批准了两款NS3/4A蛋白酶抑制剂类DAA新药:先灵葆雅(Schering-Plough)和默沙东开发的波普瑞韦(Victrelis, 化学名boceprevir),以及由福泰制药(Vertex)和强生(Johnson & Johnson)开发的特拉普瑞韦(Incivek, 化学名telaprevir)。这两款新型口服药显著提升了治愈率,并常常缩短了治疗周期。与当时的SOC联用后,可将基因1型的治愈率提高至60%至80%,部分患者的疗程甚至缩短至24周。但这些新药仍需与α干扰素联合使用,未能摆脱注射不便及其所带来的严重副作用。
回到北加州后,马丁和吉利德的高管团队开始筹划对Pharmasset的收购。按照惯例,为防止信息泄露,潜在的收购双方在内部讨论中通常使用代号代替彼此的真实名称。吉利德及其银行顾问将此收购案命名为“哈利计划”(Project Harry),并借用小说《哈利·波特》(《Harry Potter》)中的人物设定作为双方的代号——Pharmasset被称为“哈利”,吉利德则为“格兰芬多”(Gryffindor),寓意哈利是格兰芬多学院中的一员。有趣的是,格兰芬多的传承精神包括勇气、冒险和决心。事后看来,吉利德能成功完成这笔收购,这三种精神的确缺一不可。
在2011年7月21日名为《哈利计划简介》(Introduction to Project Harry)的内部简报中,吉利德首席运营官(COO )约翰·米利根(John Milligan,吉利德的下一任CEO)指出:“哈利是将核苷类药物纳入吉利德产品线最合适、也是最及时的方式”。他还强调,Pharmasset 是“多家公司眼中的极具吸引力的收购目标”,并警告称,“一年之后我们可能就买不到这家公司了。”

这批数据大大超出了吉利德的预期,使公司对多个关键因素的判断更加清晰和乐观,包括药物的上市时间、未来的市场渗透率等等。吉利德高管在给董事会的报告中指出,FDA在丙肝治疗试验标准方面的最新调整将有利于收购的推进,并有望加快PSI-7977的审批流程。FDA不再要求在治疗结束后24周进行持续病毒应答(SVR24)测试,而是改为只需12周随访(SVR12)。同时,FDA也已接受采用安慰剂对照的试验设计。由此,三期临床试验将“更简单、更快速”。高管团队认为,这些变动也意味着药物获得批准的可能性会大幅提升。
10月7日,米利根在电线日会议中披露的信息以及吉利德迄今为止的尽职调查结果,吉利德决定将收购报价提高至每股125美元现金。该报价相较于10月6日VRUS的收盘价溢价56%,较过去30天的平均收盘价溢价62%(尽管过去一个月内VRUS股价已有显著上涨)。普莱斯回应称,Pharmasset预计将在即将召开的AASLD年会上公布的PSI-7977相关数据将受到投资者的高度关注和积极反响,因此公司更倾向于在会议之后再决定是否进入下一步的谈判阶段。
按照往年惯例,由于丙肝领域长期缺乏突破性进展,相关项目报告通常被安排在楼上的小型会议室中,鲜有关注。然而,2011年的会议组织者显然低估了形势的变化。只需浏览会议日程和报告摘要,参会者便能察觉,11月6日(周日)下午那场名为“丙型肝炎:优化直接抗病毒药物的使用”(HCV: Refining the Use of Direct-Acting Antivirals)的分会势必要爆满。果然,会议开始前10分钟,仅能容纳约400人的2001号会议室早已人头攒动、水泄不通。工作人员不得不在相邻的会议室架设视频直播,以容纳未能入场的观众。
在收购消息公布当天,Pharmasset的股价飙升了85%。事实上,在与吉利德达成协议之前,Pharmasset的股价在过去一年中已经上涨逾三倍。相比之下,市场对吉利德的反应则显得极为消极——其股价当日下跌了9%。华尔街普遍认为,吉利德买贵了。桑福德·伯恩斯坦公司(Sanford C. Bernstein & Company)生物医药分析师Geoffrey Porges在当天的报告中评论道:“吉利德为了一个尚未验证、且仍面临重大临床风险的资产,竟然赌上了公司近三分之一的市值,这真是令人震惊。”
从 PSI-6130到PSI-7977的进化,是一场从潜力毛坯原石到璀璨钻石的飞跃。PSI-7977或索磷布韦的诞生不仅仅需要大量的创新和打磨,还需要一些运气。罗氏和Pharmasset的合作证明,即便PSI-6130(或Pharmasset)当时就被买走,买家也不一定能开发出索磷布韦。罗氏内部的科研团队对PSI-6130也进行了深入的研究,甚至发现了PSI-6026-TP(PSI-7977的药核的三磷酸形式)在细胞中的半衰期长达38小时,但终究没能开发出另一款索磷布韦。
2013年,FDA先后授予索磷布韦“突破性疗法认定”(Breakthrough Therapy Designation)和“优先审评”(Priority Review)资格。其中,“优先审评”资格于当年6月获批,显著加快了索磷布韦的审批流程;而“突破性疗法认定”则为该药品扩展了标签适应症的范围。凭借这一认定,吉利德得以在提交新药申请时,除了原计划的四项三期临床试验结果外,额外补充了两项三期研究数据,从而拓宽了索磷布韦的潜在批准适应症。
2013年12月6日,美国FDA正式批准了400毫克片剂的Sovaldi(商品名索华迪,化学名索磷布韦)上市。该药为每日一次的口服抗病毒药物,用于联合治疗多种类型的慢性丙型肝炎(HCV)感染。索磷布韦的批准基于六项三期临床研究的结果。通过与利巴韦林,或与利巴韦林和干扰素联合使用,12周治疗可在不同患者人群中实现50%至92%的治愈率。这标志着历史上首次因病毒引起的慢性疾病可以在大多数患者中被治愈。相比此前标准治疗(SOC),索磷布韦显著提高了疗效,将疗程从48周缩短至12周,且自身几乎无副作用,不易引发病毒耐药性。
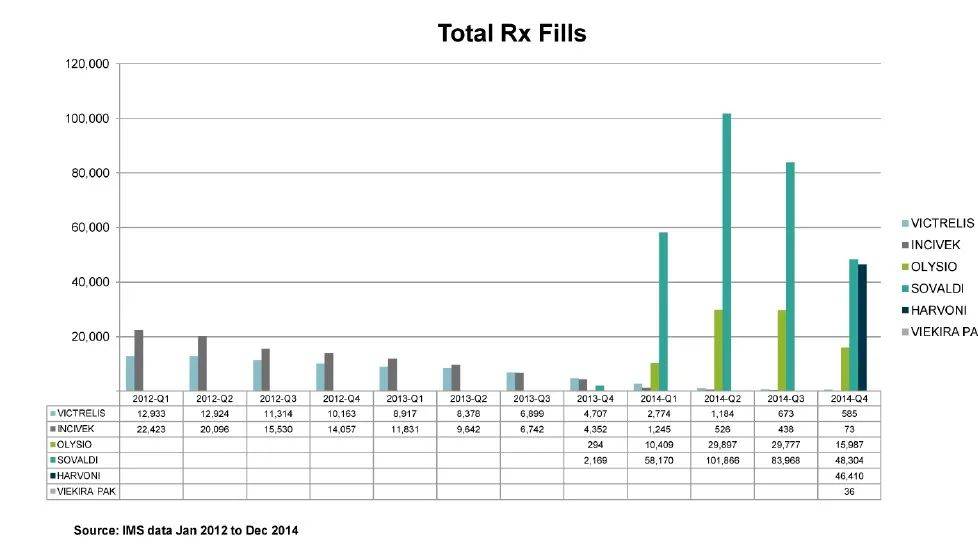
2014年10月,FDA批准了吉利德公司推出的雷迪帕韦-索磷布韦联合疗法(Harvoni),这是首个无需干扰素即可治疗基因型1丙肝患者的获批方案。Harvoni同样不需要与利巴韦林联合使用。其关键成分之一——雷迪帕韦(ledipasvir)是吉利德内部研发的一款NS5A抑制剂,而HCV的复制依赖于NS5A蛋白的功能。在多项三期临床试验中,Harvoni的治愈率(SVR12)超过95%,标志着丙肝治疗迈入了全口服、高效、低副作用的新时代。
和吉利德在HIV治疗中推出Truvada和Atripla时所采取的单片治疗策略一致,Harvoni也是一种单片口服疗法。2014年12月,Harvoni迎来了一款竞争产品——由艾伯维开发的联合疗法Viekira Pak,该药也获得了FDA批准用于治疗基因型1丙肝患者。Viekira Pak也不需要与干扰素联用,但在有的适应症上还需要利巴韦林。另外,不同于Harvoni,Viekira Pak是多片联合用药。
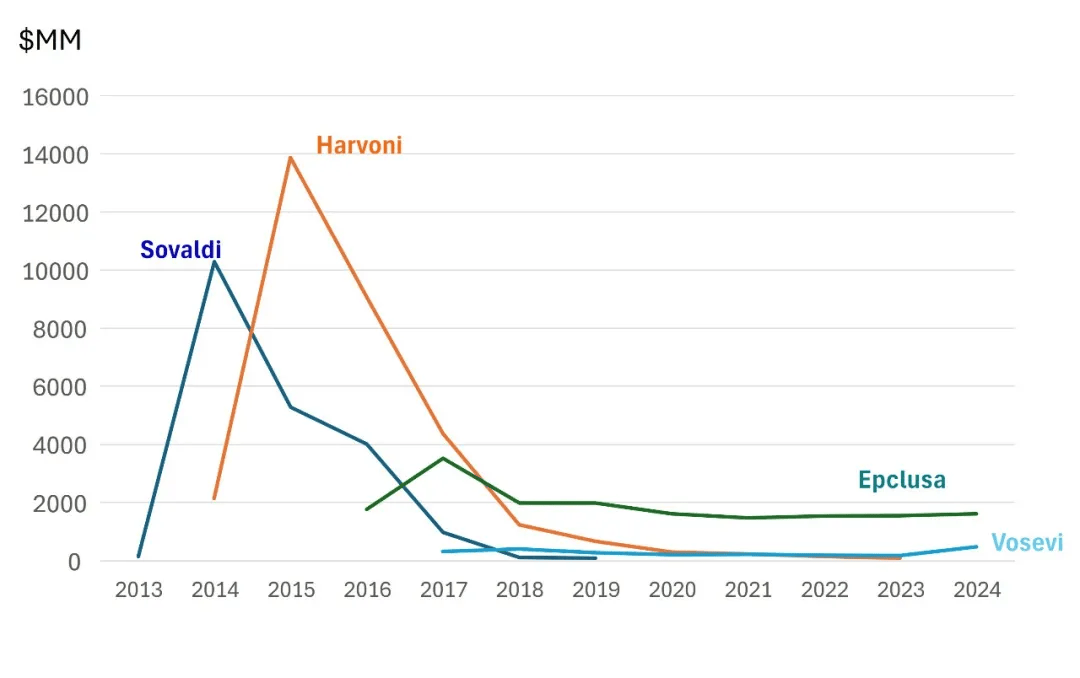
Pharmasset与吉利德的研发引擎,显然比竞争对手更精准、高效、迅速。Pharmasset当年的姊妹公司Idenix于2014年6月被默沙东以38.5亿美元收购。但Idenix管线的所有丙肝候选药物,包括当时被Pharmasset团队用作阳性对照的“Idenix化合物“NM-107及其前药valopicitabine,均止步于或缓行在临床阶段。默沙东事后承认,Idenix曾经拥有的明显的先发优势最终荡然无存。 由于临床开发严重滞后,默沙东在2016年年报中对Idenix的核心资产uprifosbuvir(IDX21437, MK3682)进行了减值处理,导致账面损失高达29亿美元。 相较之下,吉利德以112亿美元收购 Pharmasset 的交易显得愈发物超所值。
早在2012年,医生和患者便开始翘首以待索华迪的上市。由于干扰素治疗方案副作用严重,且疗效有限,再加上丙肝病程相对缓慢,不少医生建议患者延迟治疗,等待更温和、更快速、更有效的新疗法问世。这一做法被称为“囤积治疗”(warehousing)。伊坎医学院(Icahn School of Medicine at Mount Sinai)肝病科主任斯科特·弗里德曼(Dr. Scott Friedman)表示:“我绝不会在距离无干扰素疗法面世仅有一年的时候,还让他们接受干扰素治疗。在那段时间里,新确诊的患者几乎都没有立刻开始治疗。”

两款丙肝药物的推出,突然为政府和私有保险体系带来了沉重负担。联邦医疗保险(Medicare)、医疗补助计划(Medicaid)以及商业保险公司在为患者开具这两款药物时设立了层层限制:无明显肝病症状的患者不给药,毒品筛查未通过的不给药等等。即使保险公司承担了大部分费用,患者个人仍需支付超过2万美元的药费。此外,多州监狱系统也表示,索华迪的高昂定价限制了它在囚犯中的使用,而这正是丙肝感染率最高的人群之一。参议院的调查报告中特别指出了索华迪对监狱医疗系统造成的财政压力。
在施纳齐的协调推动下,两年后,吉利德同意以每个疗程仅仅900美元的价格,向埃及政府提供首批25万个疗程的索华迪,而政府则将其免费分发给患者。此后,吉利德还授权少数几家印度和埃及本地公司生产并销售该药物,仅收取极低的许可费。随着生产成本的进一步降低,埃及政府采购索磷布韦的价格最终降至每疗程60美元。目前已有超过500万埃及丙肝患者成功治愈。在全球丙肝患病率分布图上,埃及从过去的红(患病率 3%),转变为如今的绿(患病率 1%)。施纳齐因此在埃及成为了家喻户晓的人物。
尽管全球有数百万学术研究人员、超过 5000 家生物制药和生物技术公司,每年经美国 FDA 批准上市的新药却仅约 50 款,其中多数还是“me too”药物。事实上,能成功研发出一款获批药物的公司不到 1%,而能开发出多款真正造福数百万人的“重磅炸弹”级药物的企业更是屈指可数。多数大型制药公司往往依赖其资源优势,通过引进许可(in-licensing)方式获得最有潜力的外部创新成果。这种模式,正是整个新药开发生态系统赖以运作的方式。